Pada saat ini telah ditemukan lebih dari
seratus unsur dan begitu banyak senyawa kimia yang telah disentesis.
Bagaimana agar kita mudah mempelajari unsur-unsur itu? Para ahli kimia
telah mengelompokkan unsur-unsur berdasarkan sifat-sifat kimia dan
fisika yang mirip atau sama.
Untuk mempelajari
pengelompokan unsur-unsur berdasarkan sifatnya dapat digunakan tabel
periodik unsur. Tabel periodik Unsur berkembang mulai dari cara
pengelompokan yang sederhana sampai yang lengkap. Tabel periodik yang
digunakan sekarang adalah tabel periodik modern yang disusun berdasarkan
kenaikan nomor atom dan kemiripan sifat unsur. Pada tabel periodik
modern, unsur-unsur dikelompokkan dalam golongan dan periode.
Pada tabel periodik Unsur, lambang unsur dilengkapi dengan nomor atom
dan massa atom. Dari data tersebut kita dapat menentukan struktur atom
suatu unsur ffffseperti proton, neutron, elektron, dan konfigurasi
elektronnya.
Dalam tabel periodik unsur kita dapt
mempelajari sifat unsuir seperti logam, metaloid, non logam, dan sifat
periodik yaitu jari-jari, enenrgi ionisasi, afinitas elektron dan
keelektronegatifan.
A. Perkembangan Tabel Periodik Unsur
Pengelompokkan unsur-unsur dimulai oleh
Antonine Lavovoisier yang mengelompokkan unsur menjadi logam dan non
logam. Selanjutnya pengelompokkan unsur berkembang dalam berbagai bentuk
dan dikenal dengan Triade Doberiener, Oktaf Newlands, Tabel Periodik
Unsur Lothar Meyer dan Mendeleve, serta Tabel Periodik Modern.
1. Tabel Periodik Unsur Antoine Lavoisier
Antoine Lavoisier pada tahun 1789,
seorang ahli kimia Perancis membagi unsur-unsur menjadi empat kelompok.
Untuk mengenal pengelompokannya, perhatikan Tabel 1.1.
Tabel 1.1 Pengelompokan unsur oleh Antoine Lavoisier
Pada Tabel 1.1 tertera cahaya dan kalor yang bukan unsur. Pada kelompok IV dimasukkan senyawa yang belum dapat diuraikan menjadi unsur yang dikenal sekarang.
2. Hukum Triade Dobereiner
J.W. Dobereiner pada tahun 1817 mengelompokkan unsur yang mempunyai sifat sama, tiap kelompok terdiri dari tiga unsur yang disebut triade.
Untuk mempelajari hukum ini lakukan kegiatan berikut.

Dobereiner mencoba mengelompokkan
unsur-unsur yang mempunyai sifat sama berdasarkan kenaikan massa
atomnya, ternyata didapat keteraturan. Jika tiga unsur diurutkan
berdasarkan kenaikan massa atomnya, maka massa unsur yang kedua sama
dengan massa rata-rata unsur pertama dan ketiga. Pernyataan ini dikenal
dengan nama Hukum Triade Dobereiner.
3. Hukum Oktaf Newlands
Pada tahun 1863, J.W. Newlands
mengurutkan unsur berdasarkan kenaikan massa atomnya. Bagaimana
keteraturan yang ditemukannya? Coba diskusikan pengelompokannya melalui
kegiatan berikut
Dari pengelompokan ini ternyata unsur yang kedelapan memiliki sifat
yang mirip dengan unsur yang pertama, begitu juga unsur yang kesembilan
sifatnya mirip dengan unsur yang kedua, dan seterusnya. Contohnya, unsur
H sifatnya mirip dengan unsur F dan Cl, unsur Li mirip dengan Na dan K,
serta unsur Be mirip dengan Mg.
Pengulangan ini oleh Newlands disebut
Hukum Oktaf karena dia membandingkan pengulangan sifat unsur dengan
tangga nada atau oktaf pada lagu. Newlands memelopori penyusunan
unsur-unsur yang sifatnya mirip pada kolom vertikal. Kelemahan hukum
oktaf yaitu pengulangan setiap 8 unsur hanya cocok untuk unsur-unsur
yang massa atomnya kecil. Selain itu masih ada unsur- unsur yang
berimpitan pada urutan yang sama.
4. Tabel Periodik Unsur Lothar MeyerPada tahun 1870, Lothar Meyer mencoba membuat daftar unsur-unsur dengan memperhatikan sifat fisika yaitu volum atom. Dia membuat grafik volum atom unsur terhadap massa atomnya.
Untuk mempelajarinya lakukan kegiatan berikut.

Pada lengkung Meyer, unsur-unsur Li, Na, K, Rb, dan Cs menempati kedudukan yang setara, yaitu di puncak. Be, Mg, Ca, Sr, dan Ba berada di titik kedua dari puncak. Ternyata unsur-unsur yang letaknya setara memiliki sifat yang mirip.
5. Tabel Periodik Unsur Mendeleev
Dimitri Ivanovich Mendeleev pada tahun
1869 di Rusia mengemukakan hubungan antara massa unsur dengan sifat
unsur. Dalam mempelajari ke- periodikan unsur-unsur, Mendeleev selain
menggunakan sifat fisika juga menggunakan sifat kimia. Pada
penelitiannya seperti New-lands, Mendeleev juga menyusun unsur menurut
kenaikan massa atom relatifnya dan dia menemukan adanya perubahan sifat
secara periodik.
Kelebihan tabel periodik unsur Mendeleev adalah sebagai berikut.a. Merupakan sistem periodik pertama yang disusun dalam bentuk tabel yang terdiri dari delapan lajur vertikal atau golongan dan tujuh deret horizontal atau periode. Selanjutnya disebut tabel periodik unsur Mendeleev.
b. Ada tempat yang kosong bagi
unsur-unsur yang diramalkan akan ditemukan dan diberi nama eka boron,
eka aluminium, dan eka silikon. Ramalan tersebut terbukti dengan
ditemukannya Scandium (1879), Galium (1875),dan Germa- nium (1886).
Contoh ramalan Mendeleev untuk Germanium yang disebut eka silikon
tertera pada Tabel 1.2.
Tabel 1.2 Ramalan Mendeleev tentang sifat unsur germanium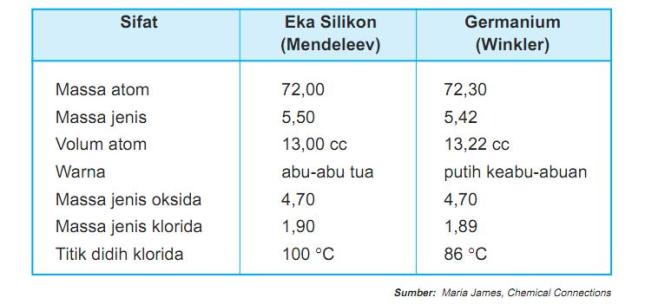
c. menempatkan unsur He, Ne, Ar, Kr, Xe, dan Rn dalam golongan tersendiri setelah golongan gas mulia ditemukan.
Tabel periodik unsur Mendeleev digambarkan seperti berikut.
Selain keunggulan, tabel periodik unsur Mendeleev mempunyai beberapa kelemahan yaitu sebagai berikut.
a. Ada beberapa urutan unsur yang
terbalik jika ditinjau dari bertambahnya massa atom relatif, misalnya Te
(128) ditempatkan sebelum I (127).
b. Triade besi (Fe, Co, Ni), triade
platina ringan (Ru, Rh, Pd), dan triade platina (Os, Ir, Pt) dimasukkan
ke dalam golongan VIII. Di antara unsur-unsur golongan ini hanya Ru dan
Os yang mempunyai valensi 8.
6. Tabel Periodik Modern
Tabel periodik unsur yang digunakn
sekarang yaitu Tabel Periodik Unsur Modern. Setelah tabel periodik unsur
Mendeleev, pada tahun 1915 Henry Mosley menemukan nomor atom dan
menyusun unsur-unsur dalam tabel periodik berdasarkan kenaikan nomor
atom dan menyususun unsur-unsur dalm tabel periodik berdasarkan kenaikan
kenaikan nomor atom. beberapa penelitian, menunjukkan adanya hubungan
antara nomor atom dengan sifat -sifat unsur, maka tabel peridik
Mendeleev perlu penyempurnaan. pada Tabel periodik Unsur modern disusun
dalam golongan dan periode
Ada 2 sistem yang digunakan pada
penomoran golomgan yaitu sistem Amerika dan sistem IUPAC. Sistem Amerika
menggunakan angka romawi I sampai VIII, masing-maing terdiri dari
golongan A dan B. Sistem IUPAC ( Internasional Union Pure and Applied
Chemistry ) menggunakan agka Arab 1 sampai dengan 18.
Oleh karena sistem penomoran golongan
IPAC belum memasyarakat di kalangan ahli kimia, maka pengolongan sisatem
amerika lebih banyak digunakan begitu juga di Indonesia.
Tabel periodik unsur modern digambarkan sebagai berikut.






 Ringkasan Materi
Ringkasan MateriStruktur Atom Dan Sistem Periodik Unsur
Apakah yang dimaksud dengan atom? Atom
adalah partikel terkecil dari unsur yang masih memiliki sifat unsur yang
disusunnya. Atom berukuran sangat kecil sehingga tidak dapat dilihat
dengan mata telanjang. Akan tetapi, para ilmuwan mampu menentukan ukuran
dan sifat-sifat atom. Penentuan itu diperoleh dari berbagai penelitian
yang mereka lakukan. Perkiraan mengenai gambar atom disebut model atom. Karena
penelitian mengenai atom dilakukan secara bertahap, model atom
mengalami beberapa penyempurnaan atau mengalami perkembangan sesuai
teori atomnya.
- Perkembangan Teori Atom
- Teori atom Dalton
- Atom adalah bahagian terkecil suatu unsur
- Atom tidak dapat dibagi lagi
- Atom-atom unsur sejenis mempunyai sifat-sifat yang sama, sedangkan atom-atom unsur tidak sejenis mempunyai sifat-sifat yang berbeda.
- Reaksi kimia terjadi karena penggabungan dan pemisahan atau pemutusan ikatan antar atom
- Atom merupakan bola kecil yang keras, padat, dan tidak dapat dibagi lagi
- Dasarnya : Hukum kekekalan massa dan hukum perbandingan tetap
- Kelebihan : Teori atom yang pertama kali dikemukan dan didilandasi data ilmiah
- Kekurangan :Belum mengemukakan adanya muatan dalam suatu atom
- Teori Atom Thomson
- Atom merupakan bola bermuatan positif dan ditempat-tempat tertentu terdapat electron yang bermuatan negative.
- Muatan positif sama dengan muatan negatif, sehingga atom bermuatan netral
- Dasarnya : dengan percobaan tabung sinar katode
- Kelebihan : sudah mengemukakan adanya muatan atom yaitu muatan positif dan negatif
- Kekurangan : belum menggambarkan letak dan lintasan electron dalam suatu atom
- Ernest Rutherford
- Atom tersusun atas inti atom yang bermuatan positif karena mengandung proton dan electron yang bermuatan negatif yang beredar mengelilingi inti.
- Atom bersifat netral, maka jumlah proton dalam inti sama dengan jumlah electron yang mengelilingi inti.
- Dasarnya : hamburan sinar £ dari uranium yang disimpan dalam wadah terbuat dari timbal. Sinar alfa yang keluar diarahkan pada lempeng tipis logam emas.
- Kelebihan : sudah mengemukakan adanya electron yang mengelilingi inti
- Kelemahan : electron yang bergerak makin lama jatuh keinti dengan lintasan bentuk spiral
- Neils Bohr
- Electron beredar mengelilingi inti pada lintasan (n) atau kulit tertentu yang berbentuk lingkaran.
- Energi electron dalam lintasannya menyatakan tingkat energi.
- Electron dapat berpindah dari lintasan.
- Jika berpindah dari lintasan dalam keluar memerlukan energi.
- Jika berpindah dari lintasan luar kedalam melepaskan energi.
- Dasarnya : Spektrum Hidrogen
- Kelebihan : Bisa menjelaskan kenapa electron tidak bisa jatuh keinti.
- Kelemahan : tidak dapat menerangkan penguraian garis-garis spectrum atom hidrogen dibawah medan magnet.
- Model atom modern
- Electron dalam atom dapat dipandang sebagai partikel gelombang (Broglie)
- Letak dan kedudukan electron dalam atom tidak dapat dipastikan, yang ada hanyalah kebolehjadian (kemungkinan) electron berada yang disebut orbital (Heisenberg)
- Gambaran gerakan electron dalam atom berupa gelombang (menurut Schrodinger).
- Dasarnya : teori dualisme dan persamaan gelombang.
- Kelebihan : bias menerangkan penguraian garis-garis spectrum atom hidrogen.
Gambar model atom
Buatlah gambar model masing-masing teori atomnya!
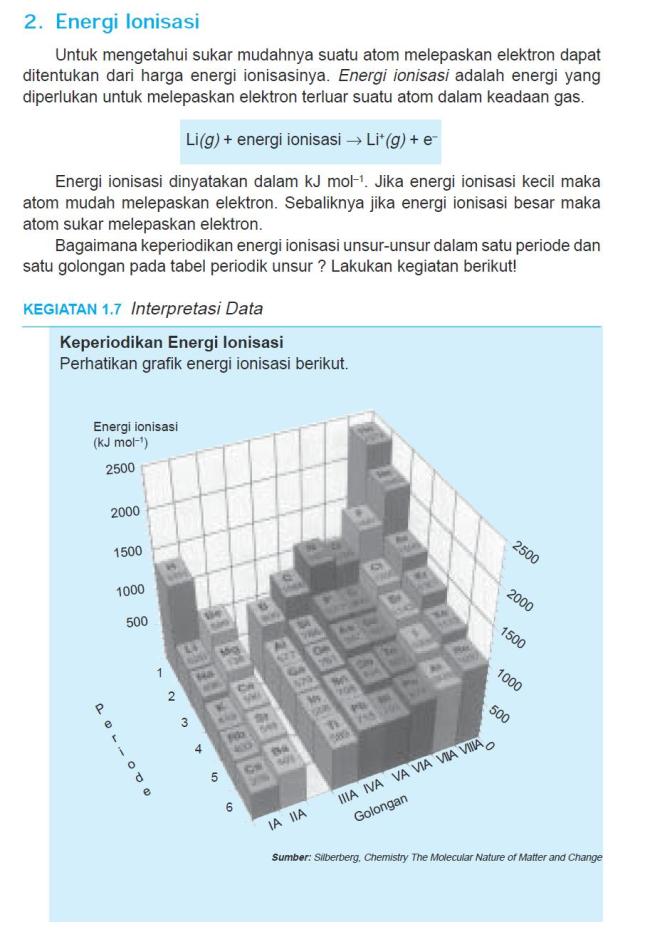
1. Perkembangan Tabel Periodik Unsur
Pengelompokkan CD dan kaset ditoko kaset ditoko music akan memudahkan
pengunjung menemukan barang yang dicari, demikian juga dengan
penyusunan unsur-unsur kimia dalam tabel periodik.Unsur dapat memiliki sifat yang sama atau berbeda, untuk mempermudah mempelajari dilakukan upaya pengelompokkan. Perkembangan pengelompokkan tersebut dimulai dari :
1. Pengelompokkan Unsur Logam dan Non Logam
Oleh : Antonie Lauren Lavoisier
Sampai abad ke-16 Lavoisier mencatat 16 unsur logam dan 7 unsur bukan logam.
- Dasar pengelompokkan : Kemiripan sifat fisik
- Kelebihan : Merupakan upaya pertama pengelompokkan unsur
- Kekurangan
Oleh JW Dobereiner
“Jika tiga unsur didalam triade disusun menurut kenaikan massa atomnya, massa atom ditengah sama dengan massa rata-rata unsur ke-1 dan ke-3”
- Dasar pengelompokkan : Kenaikan massa atom
- kelebihan : Merupakan upaya pertama penggolongan unsur
- Kekurangan : tidak berhasil menunjukkan cukup banyak triade.
- Hukum Oktaf
“Jika unsur-unsur disusun berdasarkan kenaikan massa atomnya, sifatnya akan berubah secara teratur atau periodik”
- Dasar pengelompokkan : kenaikan massa atomnya.
- Kelebihan : lebih kompleks dibandingkan hukum triade
- Kekurangan : pengulangan setiap delapan unsur hanya cocok untuk unsur-unsur yang massa atomnya kecil/unsur-unsur ringan.
- Sistem Periodik Meyer
“Jika unsur disusun berdasarkan pertambahan massa atomnya, sifat fisis akan berubah dan berulang-ulang secara periodik”
- Dasar pengelompokkan : pertambahan massa atom
- Kelebihan :
- Sistem Periodik Mendeleev
“Sifat-sifat unsur merupakan fungsi dari periodik dari massa atom relatifnya”
- Dasar pengelompokkan : massa atom relative
- Kelebihan : Unsur-unsur yang belum ditemukan dapat diramalkan sifat-sifatnya secara tepat.
- Kekurangan : adanya tempat-tempat kosong dalam tabel periodik yang terbentuk, atau hukum periodic belum terpenuhi,
- Sistem Periodik Modern
“Sifat-sifat unsur merupakan fungsi periodik dari nomor atomnya”
- Dasar pengelompokkan : kenaikan nomor atom
- Kelebihan : lebih sempurna dibandingkan periodik Mendeleyev
(
Struktur Atom Dan Sistem Periodik Unsur- Penentuan Struktur Atom Berdasarkan Tabel Periodik
- Penentuan Golongan dan Periode Unsur-Unsur dalam tabel periodik
electron, periode dan golongan suatu unsur dapat ditentukan.
Berdasarkan teori atom Bohr, Konfigurasi elektron menyatakan susunan elektron pada lintasannya. Lintasan elektron disebut dengan kulit atom. Kulit elektron disimbolkan dengan n (n =1 untuk kulit pertama, n=2 untuk kulit kedua dan seterusnya). Kulit atom n = 1, n = 2, n = 3, . . . dinamakan kulit K, L, M, . . . secara umum, konfigurasi elektron untuk atom unsur-unsur ≤ 20 mengikuti aturan berikut,
- Pengisian elektron dimulai dari tingkat enenrgi terendah, yakni kulit K.
- Jumlah maksimum elektron pada kulit K adalah 2, sedangkan pada kulit L dan M masing-masing 8
- Untuk atom dengan nomor atom 19 sampai 20, pengisian elektron sampai kulit N.
Nomor Periode : Jumlah kulit (n)
Nomor golongan : Jumlah electron valensi (jumlah elektron pada kulit terluar)
Ketentuan ini tidak berlaku untuk He
Untuk golongan transisi (golongan B) nomor periode tetap ditentukan oleh jumlah kulit, tetapi golongan tidak ditentukan oleh elektron valensi, elektron valensi berbeda dengan elektron valensi pada golongan utama.
Tabel kedudukan suatu unsur dalam system periodik berdasarkan konfigurasi elektronnya untuk nomor atom ≤ 20
Unsur
|
Nomor Atom
|
Kulit
|
Periode
|
Golongan
|
|||
K
|
L
|
M
|
N
|
||||
| Hidrogen (H) |
1
|
1
|
1
|
IA
|
|||
| Helium (He) |
2
|
2
|
1
|
VIIIA
|
|||
| Litium (Li) |
3
|
2
|
1
|
2
|
IA
|
||
| Berilium (Be) |
4
|
2
|
2
|
2
|
IIA
|
||
| Boron (B) |
5
|
2
|
3
|
IIIA
|
|||
| Kabon (K) |
6
|
2
|
4
|
IVA
|
|||
| Nitrogen (N) |
7
|
2
|
5
|
VA
|
|||
| Oksigen (O) |
8
|
2
|
6
|
VIA
|
|||
| Fluorin (F) |
9
|
2
|
7
|
VIIA
|
|||
| Neon (Ne) |
10
|
2
|
8
|
VIIIA
|
|||
| Natrium (Na) |
11
|
2
|
8
|
1
|
|||
| Magnesium (Mg) |
12
|
2
|
8
|
2
|
|||
| Aluminium (Al) |
13
|
2
|
8
|
3
|
|||
| Silicon (Si) |
14
|
2
|
8
|
4
|
|||
| Fosforus (P) |
15
|
2
|
8
|
5
|
|||
| Belerang (S) |
16
|
2
|
8
|
6
|
|||
| Klorin (Cl) |
17
|
2
|
8
|
7
|
|||
| Argon (Ar) |
18
|
2
|
8
|
8
|
|||
| Kalium (K) |
19
|
2
|
8
|
8
|
1
|
||
| Kalsium (Ca) |
20
|
2
|
8
|
8
|
2
|
||
- Periode
Sistem periodik modern terdiri atas 7 periode, yaitu sebagai berikut.
Periode 1 berisi 2 unsur, disebut periode pendek
Periode 2 berisi 8 unsur , disebut periode pendek
Periode 3 berisi . . . , disebut periode . . .
Periode 4 berisi . . . , disebut periode panjang
Periode 5 berisi . . . , disebut periode . . .
Periode 6 berisi . . . , disebut periode sangat panjang
Periode 7 berisi . . . , disebut periode . . .
- Golongan
Unsur golongan transisi (golongan B) berada antara golongan IIA dan IIIA, semuanya logam
Golongan utama (golongan A) terdiri atas 8 golongan
Golongan IA disebut golongan alkali, kecuali H
Golongan IIA disebut golongan alkali tanah
Golongan IIIA disebut golongan boron
Golongan IVA disebut golongan karbon
Golongan VA disebut golongan nitrogen
Golongan VIA disebut golongan oksigen
Golongan VIIA disebut golongan halogen
Golongan VIIIA disebut golongan gas mulia
- Penentuan elektron Valensi dari konfigurasi elektron pada tabel periodik
Elektron valensi unsur dalam system periodik untuk nomor atom 1 sampai 12
Atom
|
Konfigurasi elektron
|
Elektron Valensi
|
1H
|
1 |
1
|
2He
|
1 2 |
2
|
12Mg
|
2 8 2 |
2
|
Unsur
|
Letak Unsur dalam tabel periodik
|
Konfigurasi elektron
|
Elektron valensi
|
|
Periode
|
Golongan
|
|||
Li
|
2
|
IA
|
Li : 2 1 |
1
|
C
|
||||
N
|
||||
O
|
||||
Na
|
||||
Mg
|
||||
Al
|
3
|
IIIA
|
Al : 2 8 3 |
3
|
Atom
|
Letak unsur dalam tabel periodik
|
Struktur atom
|
Keterangan
|
11Na
|
Periode ke – 3
Golongan IA
|
Elektron dari atom-atom natrium menempati 3 kulit elektron dan memiliki 1 elektron valensi | |
12Mg
|
|||
13Al
|
|||
6C
|
|||
8O
|
- Diketahui unsur dengan notasi 17Cl 2. Diketahui unsur dengan notasi 8O2-
- Buatlah konfigurasi elektronnya! a. Buatlah konfigurasi elektronnya!
- Berapakah elektron valensinya? b. Berapakah elektron valensinya?
- Buatlah gambar struktur atom tersebut! C. Buatlah gambar srtuktur ionnya!
- 17Cl : 2 8 7 a. 8O2- : 2 8
2. Elektron valensi = 7 b. elektron valensi = 2
3. Gambar struktur atomnya : c. Gambar struktur ionnya:
Latihan
1. Tuliskan konfigurasi elektron dan tentukan valensi dari masing-masing spesi dibawah ini !
a. 15P b. 12Mg c. 13Al3+ g. d. O2- e. 11Na+
f. 9F g. 8O h. . 7N3- i. 9F-
2. Buatlah gambar struktur atom dan ionnya!








0 komentar:
Posting Komentar